分為定域π鍵和共軛π鍵。定域π鍵是由以π鍵連接的兩原子上與鍵軸垂直且相互平行的p軌道上各提供一個電子相配對而形成的共價鍵。其電子雲有一個通過鍵軸的對稱面(節面),在面上的電子密度為零。通過定域π鍵連接的兩個化學基團不能繞鍵軸作相對旋轉(除非將π鍵破壞)。例如乙烯分子中的C═C雙鍵由一個定域σ鍵和一個定域π鍵構成,後者的節面與分子平面相重合(圖1)。
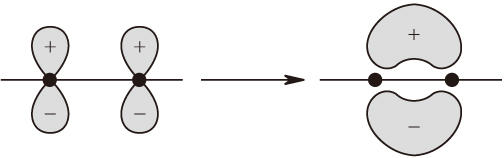 圖1 兩個p原子軌道上的電子配對形成定域π鍵
圖1 兩個p原子軌道上的電子配對形成定域π鍵
共軛π鍵則是位於同一平面上的三個或三個以上原子共享π電子而形成的共價鍵,又稱為大π鍵。例如圖2中的丁二烯分子有一個四碳原子四電子共軛π鍵。若共軛π鍵的電子總數與參加π鍵的原子數相等,稱為等電子大π鍵,如丁二烯中的;若π電子數少於原子數,稱為缺電子大π鍵,如丙烯離子(CH2═CH─CH2+)中的三原子二電子大π鍵;若π電子數多於原子數,稱為富電子大π鍵,如線形分子CO2中有兩個節面相互垂直的O─C─O三原子四電子大π鍵。共軛π鍵屬於離域共價鍵。由相互鄰接的定域π鍵形成共軛π鍵可使分子體系的能量降低、穩定性增加。能量降低幅度稱為共軛能或離域能。
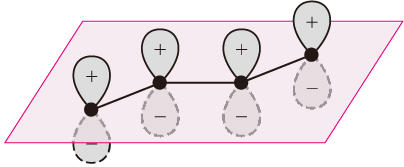 圖2 丁二烯分子中的四電子(離域)共軛π鍵
圖2 丁二烯分子中的四電子(離域)共軛π鍵