HC≡CH 純品為無色略帶芳香氣味的氣體,工業品(俗稱電石氣)則具輕微大蒜臭。常壓下不能液化,昇華點 -83.8°C。易燃、易爆。是有機合成工業的重要原料,也是有特定用途的優質高熱值燃料。
沿革 1892年,美國人T.L.威爾森在美國將煤焦油與石灰在碳質電極的電弧爐中反應,制得碳化鈣(即電石),進而與水反應得乙炔,從此乙炔開始進入工業化生產時代。隨著由乙炔合成的產品品種和數量日益益增加,乙炔需求量迅速增長。20世紀20年代以後,又發展瞭多種從烴類裂解制乙炔的方法。1965年,碳化鈣的世界產量為8.3Mt,其中62%用於制乙炔,折算乙炔量約為1.7Mt,烴制乙炔產量達到1.1Mt。以後許多乙炔化工產品可以用較低廉的乙烯為原料來制取,乙炔在有機合成工業中的需求量因而下降。1976年烴制乙炔產量降至0.8Mt,1980年電石產量降到4.08Mt。
生產方法 工業上有許多種生產乙炔的方法,按原料來源可分為兩大類:
碳化鈣法 又名電石法,是最古老且迄今仍在工業上普遍應用的乙炔生產方法。它是使電石與水在乙炔發生器中作用而制得乙炔:
CaC2+2H2O─→C2H2+Ca(OH)2
1kg電石(含碳化鈣80%)可得乙炔約310l(常溫、常壓)。工業上應用的乙炔發生器分幹式和濕式兩種。由於反應放熱大,乙炔發生器結構的設計應能使反應熱迅速移出,並防止局部過熱與超溫超壓;電石分解應盡量完全,並避免乙炔在150°C以上發生聚合等副反應。小型發生器多用濕式,用水量為化學計量值的若幹倍(1kg碳化鈣加水8~20kg),排出稀石灰乳同時移出反應熱。大型裝置多用幹式發生器,類型甚多。較多的為臥式螺旋推進型或立式塔板型。幹式發生器用水量大大減少(約與所用碳化鈣等重),排出的石灰渣含水≤4%,污染大為減輕,有些工廠也用大型的濕式發生器,操作較安全,但稀石灰灰漿的處理較麻煩。
電石為固體物料,運輸方便,制得乙炔濃度很高,隻需簡單精制即可使用。故碳化鈣法應用比較普遍,既可大規模生產,也可少量發生以用於焊接或切割。但生產電石能耗太高,發展受到限制。
碳化鈣法乙炔濃度為96~98.5%,含有硫化物、磷化氫、砷化氫、氨和乙炔衍生物等雜質,此等物質能使催化劑中毒或腐蝕金屬,在作為化工原料使用前常用稀硫酸、次氯酸鈉溶液(氯通入稀氫氧化鈉溶液)分別洗滌凈化。少量的乙炔也可用幹法凈化,采用重鉻酸鹽凈化劑、三氯化鐵凈化劑均可達到凈化要求。
烴類熱裂解法 從天然氣、輕油、原油等烴類經高溫裂解都可得到乙炔。從乙炔與低碳烷烴的生成自由焓(ΔG)與溫度的關系曲線(圖1)可見,在高溫(930~1230°C)下始能從烴類制得乙炔;其次,從反應2CH4
 C
2
H
2+
3H
2-377kJ可見生成乙炔需要大量熱能;另外,從熱力學觀點看,所有不飽和烴中乙炔在高溫下最容易分解成碳和氫。這就要求工業上必須迅速給物料供熱以達到高溫(>930°C),原料或反應產物在高溫反應區停留時間要非常短(
10
-2~
10
-3s),乙炔分壓要低,裂解氣需急冷。工業上已開發瞭很多種生產方法(見表),其主要區別是高溫熱能的產生與傳導方式不同,可大致分為直接傳熱的外熱法、部分原料燃燒的自供熱法、通過熱載體間接傳熱的外熱法。目前,工業生產使用的方法主要是電弧法和部分氧化法。
C
2
H
2+
3H
2-377kJ可見生成乙炔需要大量熱能;另外,從熱力學觀點看,所有不飽和烴中乙炔在高溫下最容易分解成碳和氫。這就要求工業上必須迅速給物料供熱以達到高溫(>930°C),原料或反應產物在高溫反應區停留時間要非常短(
10
-2~
10
-3s),乙炔分壓要低,裂解氣需急冷。工業上已開發瞭很多種生產方法(見表),其主要區別是高溫熱能的產生與傳導方式不同,可大致分為直接傳熱的外熱法、部分原料燃燒的自供熱法、通過熱載體間接傳熱的外熱法。目前,工業生產使用的方法主要是電弧法和部分氧化法。
 圖1 烴類生成的自由焓與溫度關系
圖1 烴類生成的自由焓與溫度關系
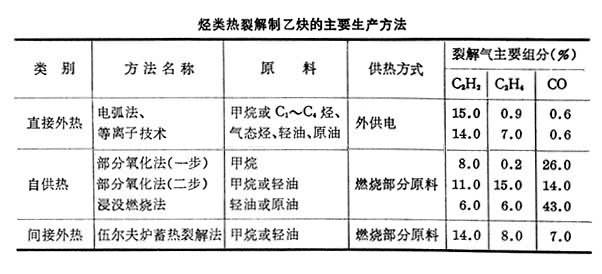 烴類熱裂解制乙炔的主要生產方法
烴類熱裂解制乙炔的主要生產方法
①電弧法 最早開發的烴制乙炔方法,以天然氣或C1~C4烴作原料,裂解所需能量由電弧提供。典型的方法如建於聯邦德國赫斯化學公司的年產100kt乙炔裝置。天然氣切線進入乙炔爐(圖2),旋轉地通過放電區;電弧溫度1725°C,反應溫度1480°C,反應時間約1.2ms,水淬冷至<175°C。反應氣中含(體積%)乙炔15,乙烯1,烯炔總收率約50,如用C2以上烴預淬冷,裂解氣濃度(%)可達乙炔16、乙烯7。每噸乙炔耗電39.06GJ,耗甲烷4350m3,副產氫氣3800m3。電弧法共建七個廠,現僅赫斯公司及羅馬尼亞的工廠繼續生產。

60年代,聯邦德國赫司特公司與赫斯公司又在電弧法基礎上開發瞭等離子技術。液態烴在2730~3730°C氫等離子流內裂解,活潑的氫離子抑制炭黑生成,故乙炔收率較高。但由於能耗高已停止生產。
②部分氧化法 反應所需熱量來自原料烴與氧的不完全燃燒,燃燒的同時發生烴的裂解反應生成乙炔。最早由德國法本公司於40年代開發,其後出現多種不同結構的乙炔反應爐,但以該公司的部分氧化法應用最廣。該法適用於天然氣中甲烷的熱裂解,甲烷與純氧分別預熱後混合,高速通過乙炔爐(圖3)的燒嘴板,在反應區生成短火焰,另導入少量輔助氧以穩定火焰。反應時間幾毫秒,在反應區出口處用水淬冷;反應區內生成炭黑要經常刮除。裂解氣組成(體積%)為乙炔8、氫57、一氧化碳26等,乙炔收率24。每噸乙炔耗甲烷4.1t、氧4.9t,副產合成氣8500m3。

新的改進是用烴代水淬冷至250°C,熱油送至廢熱鍋爐,用來產生蒸汽,以回收裂解氣中熱量,降低能耗。
烴類裂解法與碳化鈣法相比,能耗較低,適於大規模生產,但裂解氣中乙炔含量低(8%~16%),並含有少量在乙炔加工中有害的雜質,如甲基乙炔、乙烯基乙炔、丙二烯及二氧化碳等,需經提濃和凈化才能使用。工業上通常采用溶劑吸收分離方法,溶劑有水、丙酮、甲醇、液氨、N,N-二甲基甲酰胺、N-甲基吡咯烷酮等。裂解氣經水洗降溫後,用油洗或旋風除塵器或移動床焦炭吸附,脫出炭黑微粒,然後進入提濃塔(見彩圖),在中壓下用少量溶劑或液態烴吸收大量乙炔,乙烯同時被吸收並進一步被分離。然後二氧化碳與乙炔一起被大量循環溶劑吸收,二氧化碳進一步與乙炔分離,或用堿性溶液脫除。乙炔濃度高於99%。用作氯乙烯、醋酸乙烯酯單體的原料時,上述高濃乙炔尚需進一步用濃硫酸洗滌精制,以清除不飽和烴。
 乙炔提濃塔
乙炔提濃塔
此外,赫司特公司的高溫裂解法及美國聯合碳化物公司的伍爾夫蓄熱爐法均為燃燒部分原料取得高溫反應條件。前者高溫燃燒產物與裂解原料混合進入反應室,反應得到乙炔後急冷;後者為間歇式蓄熱供反應所需熱量。此類工廠因技術經濟問題大都於70年代停產。
用途 乙炔火焰亮度很高,在電燈尚未普及前大多用於工業及民用照明。乙炔在氧中燃燒時火焰溫度高達3000°C,因此廣泛用於焊接、切割金屬。60年代以前,乙炔曾是有機合成最重要的原料,以它為原料的主要產品有氯乙烯、醋酸乙烯、乙醛、丙烯腈、丙烯酸及丙烯酸酯、氯丁二烯、異戊二烯、丁二醇等,由這些產品可進一步合成種類繁多的有機化工產品。60年代末以來,隨著石油化工的發展,除丁二醇仍主要由乙炔生產外,其餘品種大多以烯烴為原料生產。但是由於乙炔化學性質十分活潑,以乙炔為原料的精細化工產品的生產近年來發展很快,例如從乙炔合成γ-丁內酯、丙炔醇、甲基丁炔醇、甲基戊炔醇、丁炔二醇、二甲基己炔二醇、四氫呋喃、Ν-甲基吡咯烷酮、乙烯基醚、甲基庚烯酮等中間體,進而加工成多種醫藥、香料、增塑劑、表面活性劑、紡織助劑及食品添加劑、膠粘劑等。
安全和貯運 乙炔易燃、易爆、易分解,在接觸熱物體、電弧或因加壓而發熱時,均能爆炸地分解為碳和氫。壓力愈高,容器截面愈大,愈易分解。在高壓及大口徑管道情況下,爆炸性火焰還能沿管道延伸。乙炔在空氣中的著火范圍與管徑大小有關:常壓下內徑大於50mm時為2.5%~80.0%(體積),0.8mm時減為8%~10%。由於乙炔的不安全性,在設計存放輸送乙炔的容器、管道及壓縮機時都必須充分考慮乙炔分解的可能,即必須考慮壓力、溫度、熱源、熱分解時可能達到的最高壓力等因素。存貯乙炔的高壓容器中必須充滿高孔隙度固體,並加入丙酮,利用丙酮對乙炔的高溶解度以貯存更多的乙炔並提高安全性,一般貯存壓力在2074~2419kPa。向乙炔容器中送氣時要註意正確選擇壓縮機、控制壓力升高速度,註意冷卻氣體和除水等。
發展趨勢 在石油化工中管式爐裂解制乙烯過程有0.2%~1%(質量)的乙炔同時生成,一般均用選擇加氫催化劑轉化為乙烯、乙烷。目前,用溶劑吸收乙炔供加工利用,成本太高,但若裂解原料向重質化改變時,乙炔在裂解氣中含量將增加,這是乙炔的一個潛在來源。
石油價格波動,各國對煤制乙炔開始重視。英國煤炭利用研究協會(BCURA)以含氫的氬等離子流電弧爐使煤中所含碳的20%~40%轉化為乙炔;美國能源部資助的阿芙科公司氫等離子電弧爐從煤制乙炔的中間試驗規模為每日10t,電弧爐容量1MW,被認為具有工業開發前途。高爐法制電石因消耗焦炭較多,還消耗純氧,電石生產成本較高,未得到發展。80年代,研究改用粉煤代焦與石灰一同加入高爐,下部鼓入純氧,同時得到電石與高濃度一氧化碳,經濟上較有競爭力。其他國傢也在進行各種煤制乙炔的研究開發工作。
參考書目
S.A.Miller,Acetylene,Its Properties,Manufacture and Uses,Ernest Benn,London,1965.
R.J.Tedeschi,Acetylene-based Chemicals FromCoaland Other Natural Resources,Marcel Dekker,New York,1982.